Read this article in English ![]()
Un tableau de bord à 15 milliards de dollars –
Le rôle critique de la qualité
du reporting dans le monde
du développement clinique
en pharmaceutique
La nécessité d’assurer la qualité du reporting décisionnel dans le cadre du développement clinique
L’industrie pharmaceutique recherche, développe et produit des médicaments destinés à la population humaine, dans le but de la guérir ou d’en atténuer les symptômes. En moyenne, il faut 10 à 15 ans et environ 2 milliards de dollars pour mettre au point un médicament et le mettre sur le marché. L’opportunité de marché est grande puisqu’en moyenne, les revenus générés sont 14,5 fois plus élevés que le coût de l’investissement en R&D. La restitution des résultats d’essais clinique doit donc être irréprochable pour éviter à la fois d’être exposée à un risque économique mais également pour éviter tout risque sanitaire. Cet article expose le rôle de ces processus qualité et les enjeux associés. Vous découvrirez les risques réels liés à une mauvaise analyse des données et l’importance de la gestion du dernier kilomètre sur le parcours de la donnée.
Une brève introduction aux essais cliniques
Lorsqu’il s’agit de développer un médicament, celui-ci doit passer par une longue série d’essais cliniques stricts afin de tester le traitement, de trouver le bon dosage et de rechercher d’éventuels effets secondaires.
- Phase 0 : Recherche préclinique sur les animaux pour vérifier si le médicament est efficace ou non.
- Phase I : Test du médicament sur des humains en bonne santé pour tester la dose maximale tolérée.
- Phase II : Test sur des personnes souffrant d’une pathologie spécifique pour vérifier l’efficacité du médicament.
- Phase III : Essais d’enregistrement pour évaluer les avantages/risques afin d’obtenir l’autorisation de mise sur le marché.
- Phase IV : Essais d’observation réalisés une fois que le médicament a obtenu l’autorisation de mise sur le marché.
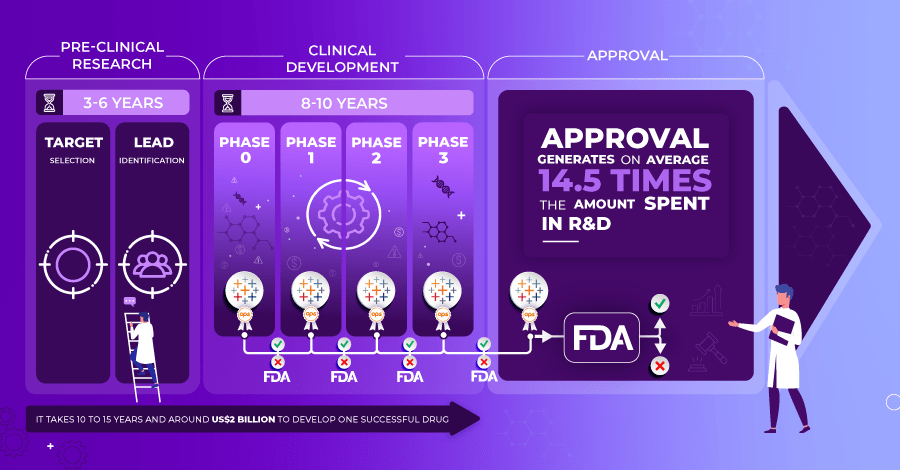
Au cours de ces phases, l’agence américaine Food and Drug Administration (FDA) joue un rôle essentiel en permettant à l’entreprise pharmaceutique de continuer de surveiller les effets et d’approuver le médicament pour un usage humain. “L’approbation d’un médicament par la FDA signifie que les données sur les effets du médicament ont été examinées par le CDER et qu’il a été déterminé que les avantages du médicament l’emportent sur ses risques connus et potentiels pour la population visée”. Si, à l’issue de la troisième phase, les chercheurs de la FDA estiment qu’un médicament est sûr et qu’il présente un rapport bénéfice/risque significatif avec un avantage important pour le patient par rapport aux produits actuellement commercialisés, la FDA approuve le nouveau produit en vue de son autorisation de mise sur le marché américain. Ce processus peut sembler assez simple et direct pour les entreprises pharmaceutiques, mais ces essais cliniques sont soumis à plusieurs réglementations, notamment en ce qui concerne les logiciels utilisés au cours du processus, ce qui fera l’objet des paragraphes ci-dessous.
Quels sont les risques liés à un mauvais reporting ?
À chaque phase des essais cliniques, l’entreprise pharmaceutique envoie à la FDA des informations sur les personnes testées, les résultats, ainsi que les avantages et les risques du médicament. La FDA analyse ensuite ces informations pour chaque phase et si tout est acceptable, l’entreprise peut passer à la phase suivante. Nous avons discuté avec plusieurs grandes entreprises pharmaceutiques et les deux enjeux suivants ont trouvé le plus d’écho :
Enjeu #1 : anticiper la mise sur le marché
“Une technologie plus efficace (par exemple, la validation continue des rapports de BI) peut-elle permettre à mon produit pharmaceutique d’être commercialisé six mois plus tôt ? Cette question est souvent posée par les cadres de l’industrie pharmaceutique, car le fait de gagner six mois sur un calendrier déjà long pourrait faire une différence considérable pour la société.
Prenons l’exemple d’une des sociétés pharmaceutiques avec lesquelles nous nous sommes entretenus et qui envoie les résultats de ses essais cliniques via des tableaux de bord Tableau. Imaginez qu’en phase III, cette entreprise a déjà dépensé 2 milliards de dollars sur 15 ans, le médicament est excellent mais dans Tableau, un problème lié à la donnée est introduit (par exemple, une anomalie s’est produite dans le cheminement des données). La FDA jugera alors que le médicament n’est pas assez bon pour être mis sur le marché et l’entreprise perdra donc l’argent investi et tout retour sur investissement potentiel. Inversement, si le tableau de bord Tableau indique que tout est parfait et merveilleux et que le médicament est mis sur le marché, mais qu’il y a ensuite des décès, cela aurait également des conséquences néfastes.
Compte tenu des énormes risques économiques et sanitaires, la FDA a adopté les réglementations GxP qui imposent aux laboratoires pharmaceutiques de tester en permanence tous les systèmes informatisés utilisés pour produire des résultats. La FDA appelle cela la fiabilité du système : “Le responsable doit s’assurer, documents à l’appui, que les systèmes informatisés sont conformes aux exigences établies par le responsable en matière d’exhaustivité, d’exactitude, de fiabilité et de constance des performances prévues”. Cela signifie que les entreprises pharmaceutiques doivent fournir une documentation sur les logiciels utilisés, sur la manière dont ils sont utilisés, avec une documentation sur les plans de test et leurs résultats, ainsi que les preuves de la qualification et de la validation du logiciel après toute modification (c’est-à-dire les mises à jour de logiciels ou les remplacements de composants).
Dans le cas de cette entreprise, qui utilise des systèmes informatisés dans la chaîne d’approvisionnement pour fournir des données sur ses essais cliniques, elle doit démontrer et documenter le contrôle total des données recueillies et restituées. Ce processus est généralement connu sous le nom de validation fonctionnelle et s’applique à tout rapport de preuves. S’il s’agissait d’un tableau de bord Tableau présentant une analyse des avantages et des risques, il devrait être validé et ferait l’objet d’un audit réglementaire. Cela permet de garantir l’intégrité de la prise de décision compte tenu des enjeux élevés, tant du point de vue de la santé que du point de vue commercial.
Donc, si nous revenons à la question initiale posée par les dirigeants de l’industrie pharmaceutique, “Une technologie plus efficace (par exemple, des tests continus) peut-elle permettre à mon produit pharmaceutique d’être commercialisé six mois plus tôt ?”, la réponse pourrait être oui, mais malheureusement, ce processus de validation fonctionnelle dans les entreprises pharmaceutiques est souvent très bureaucratique et peu flexible et implique des coûts élevés en raison de la complexité de la mise en place d’une stratégie de validation (par exemple, processus, exigences, plans de test, formation, exécution des tests). Les entreprises pharmaceutiques n’ont pas encore réalisé tout le potentiel des tests continus automatisés, même s’ils permettraient certainement d’atténuer les risques, d’améliorer l’efficacité et l’agilité et de maintenir la traçabilité dans l’industrie. Et dans ce cas, cela pourrait réduire le délai de mise sur le marché du médicament de quelques mois. Selon l’une des sociétés pharmaceutiques que nous avons interrogées, “l’automatisation des tests à grande échelle pour identifier de manière prédictive les problèmes d’intégrité des données dans le cadre d’études vastes et complexes devrait être un domaine d’intérêt pour les sociétés pharmaceutiques dans les années à venir“.
Enjeu #2
Lorsqu’un nouveau médicament potentiel fait l’objet d’essais cliniques, les dirigeants pharmaceutiques veulent également savoir comment l’investissement de 2 milliards de dollars sera utilisé. Par exemple, on nous a dit qu’ils posaient souvent la question suivante : “Quelle part de l’investissement est allouée à des processus inefficaces pour garantir la qualité de l’analyse des données ?” Un géant pharmaceutique avec lequel nous nous sommes entretenus envoie un PDF de graphiques provenant de Tableau, qui sont également soumis à des tests et à une validation. Bien qu’experts et fortement investis dans la qualité des données (collecte et stockage des données), ils n’ont pas réalisé que la qualité des données brutes n’était pas suffisante et étaient moins conscients de son équivalent, la qualité du reporting décisionnel, c’est à dire ce qui à trait à la donnée, une fois restituée dans un tableau de bord ou un rapport BI. On oublie en effet trop souvent le dernier kilomètre sur le parcours de la donnée. Le responsable médical qui signe les documents pour la FDA engage pourtant sa responsabilité si des incohérences sont introduites dans les rapports.
Il est important de noter que les résultats ou tableaux de bord Tableau sont envoyés à la FDA à la fin de chaque phase afin de pouvoir passer à la suivante, mais entre-temps, le gestionnaire de données et le scientifique des données analysent quotidiennement les données cliniques dans Tableau. Cela signifie qu’un problème peut survenir au cours des 15 années de recherche, mais qu’il aura beaucoup plus d’impact à la fin lorsqu’il sera envoyé à la FDA.
Outre les risques évidents pour la santé, il existe également un risque énorme pour le cours des actions, qui augmente après chaque phase de recherche. Par exemple, la phase I présente une toxicité acceptable, la phase II est positive avec une bonne dose d’efficacité et de risque (la valeur augmente généralement assez fortement), et la phase III est positive lorsque le produit peut nécessiter un lancement sur le marché (le prix augmente en fonction de la taille du marché et des ventes attendues). La phase IV a beaucoup moins d’impact sur le marché boursier car on dispose déjà de données en vie réelle et le produit est déjà commercialisé avec des ventes. Par conséquent, si l’entreprise doit s’arrêter à la phase 3 alors que le marché est énorme en raison d’une erreur de graphique, le cours de l’action chute. Comme vous pouvez l’imaginer, cela est très préjudiciable à l’entreprise.
L’état de l’art dans d’autres industries
Bien que l’industrie pharmaceutique ait tardé à tirer parti des tests continus, d’autres industries ont fait un travail fantastique en améliorant considérablement leurs résultats grâce à ces technologies. Par exemple, elle a encouragé Netflix à créer Chaos Monkey, un outil interne destiné à tester la résilience de son infrastructure informatique en provoquant des pannes dans un environnement réel et en vérifiant ainsi que le système informatique continue de fonctionner. Vous pouvez découvrir l’histoire complète ici. Il s’agit là d’un parfait exemple de la manière dont les tests continus automatisés sont extrêmement utiles aux entreprises pour s’assurer que tout fonctionne bien en permanence.
Solutions de test pour le reporting décisionnel en pharmaceutique
Il est clair que le besoin d’une précision absolue dans l’industrie pharmaceutique ne peut être ignoré. Les entreprises pharmaceutiques n’ont pas seulement un devoir envers elles-mêmes, mais aussi une responsabilité envers la société pour s’assurer que les médicaments qui entrent sur le marché ne sont pas dangereux. Wiiisdom fournit des solutions automatisées de BI Testing pour éliminer le risque de mauvaise qualité de données dans le cadre de leur restitution. L’étude de Deloitte sur l‘avenir de la R&D biopharmaceutique indique que “les analyses et les technologies avancées permettront l’automatisation de bout en bout de la R&D, réduisant ainsi les délais de manière significative”, ce qui souligne encore davantage la nécessité de l’automatisation, y compris l’automatisation des tests, pour garantir des données plus rapides, plus précises et plus fiables.
La qualité du reporting décisionnel au service de la santé
Toute erreur dans les tableaux de bord fournis par les entreprises pharmaceutiques au régulateur aura un impact massif tant sur le plan économique que social. Avant tout, ces entreprises ne veulent pas nuire aux patients ; Il serait catastrophique que des milliers de personnes soient impactées par un médicament mis sur le marché suite à une erreur dans un tableau de bord. Les enjeux sont considérables dans ce secteur et c’est pourquoi il est essentiel de tester en permanence les tableaux de bord afin de s’assurer que les données sont toujours exactes et que les meilleures décisions peuvent être prises.
Que ce soit pour Tableau ou d’autres solutions de BI, Wiiisdom aide à intégrer les tests d’analyse de données dans le reste de vos processus de qualité afin que vous puissiez être sûrs que vos analyses sont fiables à tout moment. Contactez-nous dès aujourd’hui si vous souhaitez en savoir plus.